12 Oct 西湖大学王怀民团队《Adv. Mater.》:利用化学策略在活细胞中构建人工生物聚集体方面取得重要进展
生物分子凝聚体是生物系统中普遍存在的现象,在控制细胞功能方面发挥着重要作用。然而,构建具有特定功能的人工生物分子聚合物仍然具有相当大的挑战性。分子自组装作为一种广泛存在于自然界的普遍现象,是化学与材料化学中常用的合成功能性物质的方法。活细胞利用酶、氧化还原和pH等因素来调控生成功能性大分子,在细胞内经常会形成液滴状的生物聚集体,这些生物聚集体在调控细胞生物功能方面具有重要作用。
受天然的生物聚集体的启发,王怀民研究团队利用设计的多肽分子的pH响应特性,在活细胞溶酶体中构建生物分子冷凝物(如水凝胶),并将其应用于癌症治疗。该研究策略解决了在肿瘤治疗过程中,化疗药物易在溶酶体内滞留引起的肿瘤细胞对化疗药物的耐药性。
如下图所示,该研究团队利用来源于人胰岛素蛋白的多肽序列,设计了在不同pH条件下形成不同形态组装体的多肽分子,利用癌细胞溶酶体的酸性环境调控多肽分子的组装,实现了多肽分子在溶酶体内的相转化(从溶液到水凝胶)。在溶酶体中形成的水凝胶扩大了癌细胞溶酶体的体积,增加了溶酶体膜的渗透性,从而导致癌细胞死亡。其次,该团队利用这一策略来提高现有化疗药物的抗肿瘤效率,为精准合成活细胞中功能性聚集体和解决癌症治疗耐药性提供了一种新的策略。

图1. A)多肽分子的化学结构式;B)多肽分子在不同pH下的组装示意图;C)多肽分子在体内的自组装过程。
设计的多肽分子由三个部分组成:来源于人胰岛素蛋白的片段肽序(VEALYL);N端修饰的2-萘乙酰基,提供芳香环-芳香环相互作用,提高多肽自组装能力;C端修饰的糖基化基团,提高多肽的蛋白水解稳定性。
对多肽分子处理过的癌细胞进行冷冻电镜考察,发现多肽分子处理过的癌细胞的溶酶体相较于未处理的癌细胞体积明显增加,且溶酶体膜破损严重。此外,在溶酶体以及细胞质中均能够观察到纤维状的组装体形成,证实了多肽分子能够促进癌细胞溶酶体膜破损,释放出溶酶体中的物质。
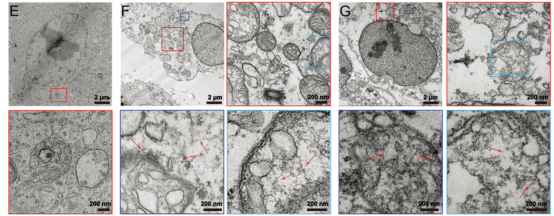
图2. Hela细胞的Bio-TEM结果。E)未处理的HeLa细胞;F)多肽分子处理24 h的HeLa细胞;G)糖基化修饰的多肽分子处理24 h的HeLa细胞。
王怀民团队又将多肽分子与化疗药物阿霉素(Dox)联合应用,发现多肽分子能够有效地提高癌细胞对药物的摄取,同时能够促进药物从溶酶体中逃逸,使其进入细胞质以及细胞核中,提高其抗癌能力。同时多肽分子与Dox的协同治疗结果显示,联合治疗组的Dox的IC50比单独Dox的IC50降低了676倍。这些结果证明,与Dox单独组相比,协同治疗组达到相同治疗效果时所需的药物剂量降低。
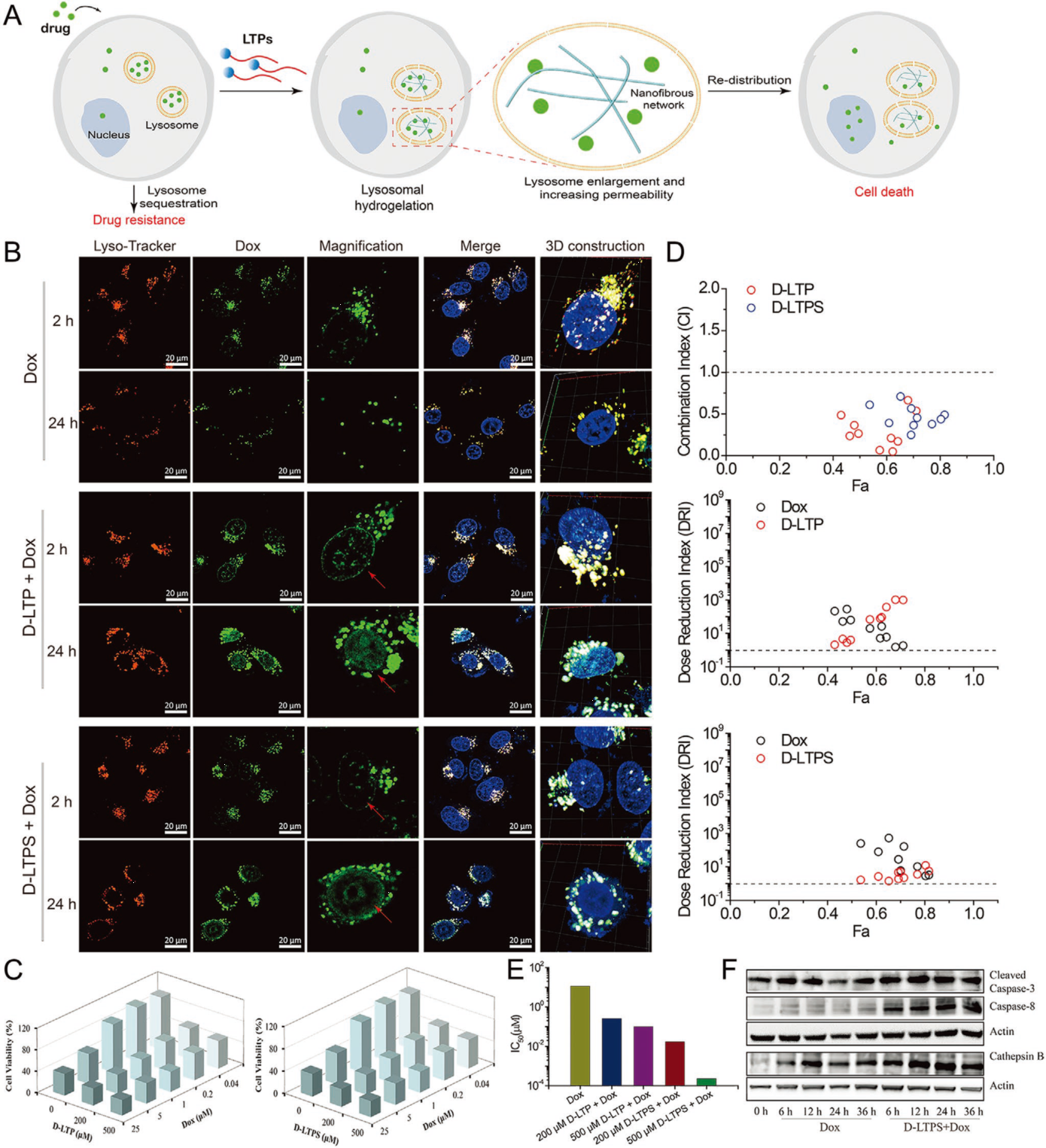
图3. 多肽分子与化疗药Dox的协同作用。A)多肽分子与化疗药协同作用示意图;B)多肽分子与化疗药在细胞内的分布结果;C)多肽分子与化疗药的协同作用结果;D)Chou-Talalay法计算的联合治疗参数CI和剂量减少指数DRI;E)不同组的化疗药的IC50;F)多肽分子与化疗药处理后的细胞凋亡因子检测。
本工作实现了在癌细胞溶酶体中通过质子化诱导多肽的相转化而形成的人工生物分子聚集体。多肽分子在溶酶体聚集导致溶酶体增大,从而改变溶酶体的渗透性,并进一步改变现有化疗药物在细胞中的分布。该工作证明了抗癌药物在细胞内分布的变化可以显著提高它们在耐药癌细胞和荷瘤小鼠模型中的抗肿瘤效率。这项工作是第一个利用在溶酶体形成凝胶状聚集体的策略改变化疗药在细胞内的分布,为提高化疗药物抗肿瘤效率提供了一个新的思路。
以上成果以题为Intracellular condensates of oligopeptide for targeting lysosome and addressing multiple drug resistance of cancer发表在《Advanced Materials》上。论文的第一作者为西湖大学博士生王菁,通讯作者是西湖大学王怀民研究员。本项目受到国家自然基金委、西湖教育基金会和腾讯基金的资助。
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/adma.202104704



